La obesidad, una de las amenazas más acuciantes para la salud pública a nivel mundial, se origina por desequilibrios prolongados entre la ingesta y el gasto de energía. Aunque las estrategias tradicionales como la restricción dietética o el uso de agonistas del receptor GLP‑1 pueden inducir pérdida de peso a corto plazo, su eficacia sostenida es limitada y frecuentemente se observa un efecto rebote. Esto resalta la urgencia de encontrar mecanismos que no solo reduzcan el apetito, sino que promuevan activamente el gasto energético.
En ese contexto, un equipo de investigadores del Instituto de Biología del Desarrollo y Genética de la Academia China de Ciencias ha revelado un hallazgo que podría transformar nuestra comprensión del control metabólico central: la identificación de una población neuronal hasta ahora poco explorada en el hipotálamo, capaz de regular directamente el gasto energético. Sus resultados se publicaron en la revista Neuron el 17 de septiembre de 2025.
El núcleo arcuato como centro de regulación metabólica
El hipotálamo, y en particular el núcleo arcuato (ARC, del inglés arcuate nucleus), desempeñan un papel central en la regulación del equilibrio entre ingesta y consumo energético. Dentro del ARC ya se conocen dos poblaciones clave de neuronas:
Las neuronas POMC (pro-opiomelanocortina), tradicionalmente vinculadas a señales de saciedad y estimulación del gasto energético.
Las neuronas AgRP/NPY (péptido relacionado con agutí / péptido neuro yeuronal Y), que promueven el apetito.
Estas dos clases han sido el foco dominante en el estudio del control metabólico durante décadas. Sin embargo, no explican completamente la diversidad funcional presente en el ARC ni cómo ciertos estímulos ambientales o fisiológicos modulan el gasto energético más allá del simple equilibrio entre comer o no comer.
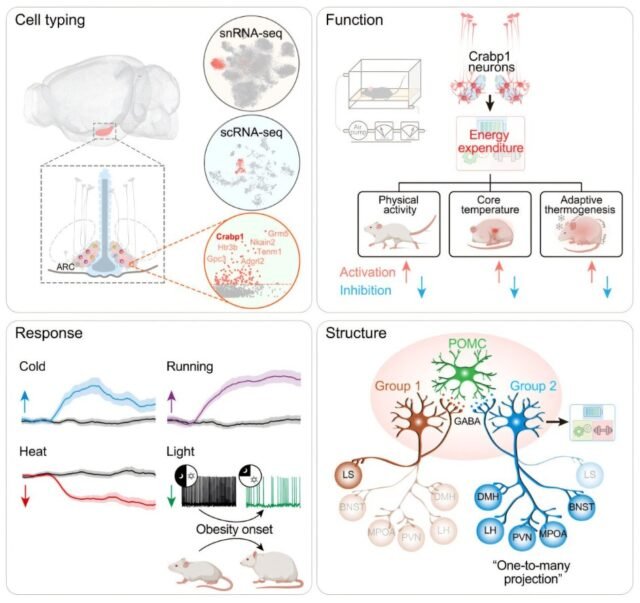
Para llenar este vacío, el equipo liderado por Wu Qingfeng aplicó técnicas avanzadas: transcriptómica de célula única, hibridización in situ y mapeo de circuitos neuronales. De esta forma, identificaron una nueva subpoblación GABAérgica diferenciada por la expresión del gen Crabp1, la cual mostró pocas coincidencias con POMC, AgRP u otros subtipos conocidos.
¿Qué son las neuronas Crabp1 del ARC?
Estas neuronas Crabp1 constituyen un grupo molecularmente singular dentro del ARC. No coexpresan (o lo hacen en muy mínima proporción) marcadores de POMC, AgRP, Kiss1, TH, CARTPT, entre otros.
En cambio, su perfil genético está enriquecido en vías vinculadas a:
Adhesión celular
Metabolismo del ácido retinoico
Señalización de hormonas tiroideas
Actividad de receptores de neurotransmisores
El ácido retinoico, derivado de la vitamina A, es un modulador biológico muy importante, y CRABP1 (proteína citoplasmática que une ácido retinoico) regula su disponibilidad celular. Esto sugiere que estas neuronas podrían tener una sensibilidad particular a señales retinoicas o ambientales lumínicas.
Adicionalmente, se identificó que estas neuronas son en su mayoría GABAérgicas (es decir, liberan GABA como neurotransmisor inhibitorio).
También expresan receptores para hormonas metabólicas relevantes: alrededor del 10,8 % de ellas expresan Lepr (receptor de leptina) y aproximadamente 35,1 % expresan Glp1r (receptor de GLP‑1).
Esto las convierte en candidatas para mediar efectos de hormonas metabólicas sobre el gasto energético.
Se ha observado también que estas neuronas responden al estado nutricional y a la administración de liraglutida (un agonista de GLP‑1), lo que indica que su actividad puede modularse por el contexto metabólico.
Función fisiológica: más allá del apetito, el control del gasto energético
Para probar la relevancia funcional de las neuronas Crabp1 en el control metabólico, los investigadores llevaron a cabo manipulaciones genéticas y optogenéticas en modelos animales:
Silenciar / eliminar las neuronas Crabp1
Al inhibir estas neuronas, los animales mostraron:
Disminución drástica del gasto energético
Menor actividad locomotora
Reducción de la temperatura corporal central
Termogénesis ineficiente en la grasa parda
Desarrollo de obesidad progresiva
Estos resultados sugieren que, sin la acción de estas neuronas, el organismo pierde su capacidad de gastar energía de manera adaptativa.
Activación de las neuronas Crabp1 (quimiogenética u óptica)
Al estimularlas, se observó un efecto contrario:
Aumento notable de la actividad motora
Mayor termogénesis (generación de calor)
Protección frente al aumento de peso inducido por dieta rica en grasas
Esto confirma que estas neuronas pueden impulsar directamente el gasto energético y contrarrestar el almacenamiento adiposo.
Estos hallazgos ubican a las neuronas Crabp1 como un centro regulador del gasto energético, distinto de las neuronas clásicas que regulan el apetito.
Circuitos y conexiones: una estrategia “one-to-many” para coordinar el gasto energético
Más allá de demostrar su función, los autores trazaron los circuitos que conectan estas neuronas con otras áreas del cerebro. Descubrieron que las neuronas Crabp1 adoptan un patrón de proyección estilo “uno a muchos”, enviando ramas colaterales hacia diferentes núcleos del hipotálamo que participan en el control metabólico:
Núcleo paraventricular del hipotálamo (PVH)
Núcleo dorsomedial del hipotálamo (DMH)
Núcleo lateral del hipotálamo (LH)
Área preóptica del hipotálamo (POA)
A través de manipulaciones específicas sobre estas vías de salida (por ejemplo, activar ciertas proyecciones), los experimentadores pudieron modular aspectos particulares del gasto energético. Esta arquitectura permite que una única población neuronal coordine múltiples facetas del metabolismo.
Este tipo de conexiones distribuidas asegura que las señales neuronales Crabp1 puedan sincronizar la actividad motora, la regulación térmica y la termogénesis contra diferentes demandas fisiológicas.
Factores ambientales, estilo de vida y regulación metabólica
Un hallazgo adicional fascinante de este estudio es cómo estímulos externos modulan la actividad de las neuronas Crabp1, lo que sugiere mecanismos neuronales mediante los cuales el estilo de vida puede afectar el metabolismo corporal:
Frío y ejercicio
Tanto la exposición a temperaturas bajas como la actividad física estimulan fuertemente las neuronas Crabp1, provocando un aumento del gasto energético para soportar la termogénesis y el esfuerzo motor.
Exposición prolongada a la luz
Por el contrario, la estimulación luminosa prolongada suprime la actividad de estas neuronas a través de la vía retinohipotalámica, lo que reduce el gasto energético y favorece la ganancia de peso. Este mecanismo pone de relieve un nexo entre la “contaminación lumínica” moderna y el incremento en obesidad/metabolopatías.
Este vínculo entre iluminación ambiental y control neuronal del gasto energético aporta una dimensión adicional a la manera en que los hábitos cotidianos (como la exposición a luz artificial) podrían predisponer a la disfunción metabólica.
Un nuevo modelo conceptual: la “modelo espejo‑desbalance” frente al modelo “balancín”
Tradicionalmente, el balance energético se conceptualizaba mediante un modelo de balancín (seesaw) en el que las neuronas AgRP y POMC dominaban la regulación del apetito y el gasto. Sin embargo, los resultados del trabajo de Wu y su equipo sugieren que esa visión es incompleta.
Ellos proponen un modelo espejo‑desbalance, donde la actividad de las neuronas Crabp1 funciona en paralelo como un eje regulador del gasto energético, complementario al control del apetito. En este nuevo marco:
Las neuronas AgRP/POMC «empujan» la ingesta de energía
Las neuronas Crabp1 «empujan» el gasto de energía
Si alguna de las ramas falla o se desequilibra (por ejemplo, por supresión lumínica o por estilos de vida sedentarios), el sistema global del equilibrio energético colapsa hacia el aumento de peso.
Este modelo más completo ayuda a explicar por qué muchas intervenciones dirigidas solo al apetito no logran resultados sostenidos: sin reforzar el gasto energético neurales, el sistema tiende al rebote.
Implicaciones para la obesidad y terapias futuras
El descubrimiento de las neuronas Crabp1 como moduladoras clave del gasto energético abre nuevas rutas potenciales para tratar la obesidad y trastornos metabólicos:
Podrían convertirse en dianas terapéuticas para estimular termogénesis sin depender exclusivamente de fármacos que inhiban el apetito.
La manipulación de sus circuitos (por ejemplo, vías ópticas o farmacológicas) podría permitir modular selectivamente el gasto energético sin afectar otras funciones homeostáticas.
Dado que expresan receptores de leptina y GLP-1, podrían mediar efectos de terapias metabólicas ya en uso o inspirar nuevos agentes más específicos.
La conexión entre señalización luminosa y metabolismo abre la posibilidad de intervenciones de estilo de vida (por ejemplo, control de exposición lumínica) como complemento para mantener un gasto energético saludable.
Por supuesto, estos estudios hasta ahora se han hecho en modelos animales; será esencial confirmar en humanos la presencia de neuronas Crabp1 equivalentes, su funcionalidad y seguridad en manipulación.
La identificación de las neuronas Crabp1 del núcleo arcuato representa un avance paradigmático en nuestro entendimiento del control neuronal del gasto energético. Al revelar una población neuronal exclusiva, con conexiones extensas, modulada por estímulos ambientales y capaz de regular múltiples aristas del metabolismo, esta investigación proporciona una base neuronal robusta para diseñar nuevas estrategias contra la obesidad.